24 mei 2023 bij Jinek: de Overgang
Soms zie je vrouwen in de overgang in een half jaar oud worden. Ze slapen slecht, hebben last van stemmingswisselingen, opvliegers, hoofdpijn, gewrichtsklachten, opvliegers en overmatig zweten. Uit onderzoek blijkt echter dat primitieve stammen die natuurlijk eten en leven geen last hebben van overgangsklachten. Met andere woorden: Deze periode die voor veel vrouwen een gruwel is, kan dus klachtenvrij zijn.Vraag gratis video consult aan! (t.w.v. €195)
In dit artikel lees je over de volgende onderwerpen:
De aanmaak van hormonen na de menopauze
Verstoorde activiteit van oestrogeen
Verhoogde aanmaak van oestrogeen
Verlaagde activiteit van progesteron
Metabole oorzaken van menopauzeklachten
Overgangsklachten zijn goed te behandelen met voeding
Goed voorbereid de overgang in!
De overgang
Menopauze is letterlijk het ophouden van de menstruatie. De menopauze wordt officieel bereikt wanneer een vrouw twaalf maanden lang geen menstruatie meer gehad heeft.
Wat in de volksmond de ‘overgang’ genoemd wordt is de perimenopauze, de periode die begint met de eerste onregelmatigheden in de menstruatie en die een jaar na de laatste menstruatie eindigt.
Er zijn twee fasen in de perimenopauze: de vroege overgang, met meestal regelmatige menstruatiecycli met af en toe een langere cyclus of een onderbreking, en de late overgang, waarin de tijd tussen twee bloedingen langer wordt en minstens zestig dagen duurt.
Toch zit hier geen vast patroon in en is het heel onvoorspelbaar. Men kan na een lange periode zonder menstruatie opeens weer een periode met een regelmatige menstruatie hebben. De overgang verloopt bij elke vrouw anders.
De ‘gemiddelde vrouw’ komt rond de leeftijd van 47 jaar in de vroege fase van de perimenopauze en rond 49 jaar in de late perimenopauze en bereikt rond 51 jaar de eigenlijke menopauze. De ‘echte vrouw’ kan daar sterk van afwijken.
Vraag gratis video consult aan! (t.w.v. €195)
Overgangsklachten
De perimenopauze verloopt bij sommige vrouwen zonder noemenswaardige symptomen, terwijl andere vrouwen last hebben van uiteenlopende (ernstige) lichamelijke, mentale en psychische klachten. Ook de duur van de perimenopauze varieert heel sterk, van één jaar tot wel tien jaar of langer.
Naar schatting negentig procent van de vrouwen zoekt medische hulp voor menopauzeklachten (Santoro N, 2016).
De meest typische klachten zijn opvliegers, nachtzweten, slaapproblemen, angst, depressie, stemmingsschommelingen, vermoeidheid, verminderd libido en vaginale droogte. Dat zijn ook de klachten waar veel vrouwen medische hulp voor zoeken.
De lijst met lichamelijke, mentale en psychische klachten die vrouwen in de overgang melden is heel lang. Heel veel van die klachten worden vaak niet gelinkt aan de menopauze, omdat ze al beginnen voor de menstruatie onregelmatig wordt en de eerste opvliegers verschijnen. Veel vrouwen beseffen pas dat ze in de overgang zitten wanneer de opvliegers frequenter en intenser worden.
De meest voorkomende klachten tijdens de (peri)menopauze
- warmteopwellingen, opvliegers (vapeurs)
- nachtelijk zweten
- slapeloosheid, slaapstoornissen
- hartkloppingen
- hoofdpijn
- duizeligheid
- depressie, angst
- vermoeidheid, lichamelijke en mentale uitputting
- prikkelbaarheid, stemmingsschommelingen, nervositeit, spanning, agressie
- achteruitgang van het geheugen en het leervermogen, concentratieproblemen
- gewichtstoename, vooral rond de taille
- verminderd libido
- droge vagina, vaginale atrofie, vaginale ontsteking
- blaasontstekingen, urine incontinentie
- pijn tijdens het vrijen (dyspareunie)
- spierpijn, rugpijn
- pijnlijke gewrichten, reumatische gewrichten
- tintelend gevoel, naaldenprikgevoel, verdoofd gevoel, kriebelend gevoel in de armen en/of benen, in het gezicht, in het hoofd, …
- Verminderde eierstokfunctie
In de perimenopauze daalt het vermogen van de eierstokken om rijpe eicellen aan te maken.
Eicellen zitten in de eierstokken verpakt in follikels. De onrijpe follikels bevatten onrijpe eicellen, die onder invloed van verschillende hormonen groeien en zich ontwikkelen tot rijpe eicellen.
Op het einde van de vruchtbare jaren zijn de follikels steeds minder goed in staat om in respons op follikelstimulerend hormoon (FSH) oestrogeen aan te maken uit androgenen (androsteendion en testosteron). Het gevolg daarvan is dat de aanmaak van oestrogeen daalt en FSH in het bloed stijgt.
Hormonale schommelingen
Tijdens de overgang kan oestrogeen heel sterk schommelen, terwijl progesteron geleidelijk daalt. Tijdens het jaar na de laatste menstruatie stopt de aanmaak van progesteron door de eierstokken, terwijl de aanmaak van oestrogeen nog kan fluctueren. Na de eigenlijke menopauze, het begin van de periode die postmenopauze genoemd wordt, stabiliseren de hormoonconcentraties zich. Hoewel zich ook daarna nog wijzigingen in de hormoonwaarden kunnen voordoen, zijn die niet meer zo drastisch als in de overgang.
Daling van oestrogeen
Een verlaagde aanmaak van oestrogeen tijdens de overgang wordt beschouwd als de belangrijkste oorzaak van menopauzeklachten. Oestrogeen wordt vooral in verband gebracht met seksualiteit en voortplanting, maar het heeft veel functies in het lichaam. Een gebrek aan oestrogeen kan heel uiteenlopende gevolgen hebben (zie kaders).
Functies & effecten van oestrogeen:
- regelt het libido, de seksualiteit en de voortplanting
- nodig voor celgroei, de groei en het herstel van weefsel
- regelt het metabolisme, de energieaanmaak in cellen
- regelt het cholesterol- en vetmetabolisme
- regelt het glucosemetabolisme (de opname en het verbruik van glucose)
- regelt het eiwitmetabolisme (de aanmaak en afbraak van eiwitten)
- stimuleert de aanmaak van collageen (bindweefsel, huid, wondgenezing)
- moduleert de immuniteit en inflammatie
- remt oxidatieve stress (antioxidant)
- regelt de werking van de spieren (opname van glucose, energieaanmaak, spierherstel, spiergroei)
- remt ontsteking en beschadiging van gewrichten
- remt de botafbraak
- regelt de activiteit van serotonine (welzijn, goed gevoel, slaap) en dopamine (beloning, motivatie)
- beschermt de zenuwcellen tegen neurotoxiciteit (neuroprotector)
- stimuleert de aanmaak van nieuwe zenuwcellen
- nodig voor het geheugen, de concentratie, de verstandelijke functies
- regelt de endotheelfunctie, het uitzetten en samentrekken van de bloedvaten
- regelt de aanmaak van nieuwe bloedvaten (angiogenese)
- regelt de lichaamstemperatuur (thermoregulatie)
Oorzaken van verlaagde oestrogeenwaarden
- menopauze, verlaagde aanmaak van oestrogeen door de eierstokken
- het verwijderen van de eierstokken
- oestrogeen verlagende medicijnen (bv. aromataseremmers, GnRH agonisten, progestagenen, danazol)
- hersenaandoeningen (de hypothalamus en de hypofyse regelen de aanmaak van oestrogeen)
- gebrek aan cholesterol (de grondstof van oestrogeen)
- te weinig lichaamsvet (anorexia, topsport)
- chronische stress
- het gebruik van corticosteroïden
Mogelijke gevolgen van een gebrek aan oestrogeen of een verlaagde activiteit van oestrogeen
- verminderd libido
- droge vagina, vaginale infecties, dunner worden van de vaginale wand (vaginale atrofie)
- kleine, slappere borsten
- opvliegers, nachtzweten
- blaasontstekingen, urineweginfecties, incontinentie
- stemmingsschommelingen, depressie, angst
- achteruitgang van het geheugen en de verstandelijke functies
- botverlies, osteoporose
- spierpijn, spierontsteking
- spierzwakte, verlies van spiermassa
- gewichtstoename, vetopslag rond de taille
- verstoorde immuniteit, verzwakte weerstand
- vermoeidheid
- slaapproblemen
- huidveroudering
- slechte wondgenezing
- haaruitval
Daling van progesteron
Het is vooral progesteron dat daalt tijdens de perimenopauze. Progesteron begint al in de vroege perimenopauze geleidelijk te dalen, terwijl oestrogeen het grootste deel van de overgang sterk schommelt - en vaak zelfs verhoogd is - en pas in de late perimenopauze begint te dalen (Catenaccio E, 2016).
Veel menopauzeklachten kunnen het gevolg zijn van een verlaagde activiteit van progesteron, vooral in verhouding tot oestrogeen.
Progesteron bereidt de baarmoeder voor op een zwangerschap, zorgt voor het behoud van de zwangerschap en stimuleert de groei van melkklieren. Het wordt beschouwd als een ‘zwangerschapshormoon’ maar het heeft nog veel meer functies in het lichaam (zie kader).
Vraag gratis video consult aan! (t.w.v. €195)
Functies & effecten van progesteron
- bereidt de baarmoeder voor op een zwangerschap
- onderdrukt een nieuwe ovulatie tijdens de zwangerschap
- zorgt voor het behoud van de zwangerschap
- stimuleert de groei van melkklieren
- normaliseert de bloedsuikerspiegel
- stimuleert de werking van de schildklier
- houdt oestrogeen in evenwicht, gaat de gevolgen van te veel oestrogeen tegen (verlaagt het aantal oestrogeenreceptoren)
- vermindert het risico op oestrogeengevoelige kankers
- heeft een kalmerend effect (bindt op GABA-receptoren)
- stimuleert het parasympathisch zenuwstelsel (rust en herstel)
- heeft een pijnstillend effect
- heeft een diuretische, vochtafdrijvende werking (gaat de werking van aldosteron tegen)
- verhoogt het libido
- ontspant de gladde spieren, vermindert baarmoedercontracties (menstruatiekrampen)
- stimuleert de botvorming, herstelt botbeschadiging
- beschermt de hersencellen tegen neurotoxiciteit
- stimuleert de aanmaak van myeline rond zenuwcellen
- remt de afbraak van collageen
- heeft een ontstekingsremmend, immuunonderdrukkend effect
Mogelijke gevolgen van een gebrek aan progesteron of een verlaagde activiteit van progesteron
- onvruchtbaarheid
- vroege miskraam
- pijnlijke borsten, borstcysten
- premenstrueel syndroom
- vochtophoping
- gewichtstoename
- haarverlies op het hoofd
- haargroei in het gezicht
- angst, paniekaanvallen
- niet tegen stress kunnen
- agressief gedrag
- slapeloosheid
- auto-immuniteit
- botverlies, osteoporose
De aanmaak van hormonen na de menopauze
De daling van oestrogeen en progesteron na de vruchtbare jaren is een normaal verschijnsel. De eierstokken hebben geen oestrogeen en progesteron meer nodig, omdat er geen eicellen meer moeten rijpen en geen zwangerschap moet voorbereid en in stand gehouden worden.
Oestrogeen en progesteron zijn echter belangrijke regulerende hormonen voor andere lichaamsfuncties en de aanmaak ervan wordt niet volledig gestopt. Er wordt vaak gezegd dat de eierstokken na de menopauze geen oestrogeen meer aanmaken, maar dat is niet zo. Ze blijven ook na de menopauze nog androgenen en oestrogeen aanmaken, alleen veel minder dan in de vruchtbare jaren (Maruoka R, 2014; Fogle RH, 2007).
Oestrogeen, progesteron en testosteron worden na de menopauze vooral aangemaakt in de bijnieren, in vetweefsel en in de hersenen. Oestrogeen wordt ook aangemaakt in de botten, de lever, de pancreas, de darmen, de nieren, de milt, de huid en de bloedvaten (mogelijk in alle weefsels) (Barakat R, 2016). Vermoedelijk geldt dat ook voor progesteron en testosteron. Men ontdekt steeds meer celtypen die de enzymen bevatten die nodig zijn voor de aanmaak van geslachtshormonen uit cholesterol en voor de omzetting van progesteron in androgenen en van androgenen in oestrogeen.
Hoewel na de menopauze veel minder oestrogeen en progesteron aangemaakt wordt dan voor de menopauze en er veel minder oestrogeen en progesteron in het bloed circuleert, is er normaal nog voldoende voor alle lichaamsfuncties die oestrogeen en progesteron nodig hebben, behalve voor de voortplanting. Oestrogeen kan in de cellen zelf aangemaakt worden uit testosteron.
De bloedwaarden van oestrogeen zijn geen goede afspiegeling van oestrogeen in de cellen en weefsels. Oestrogeen kan tijdens de menopauze zelfs te actief zijn in bepaalde weefsels. Het effect van oestrogeen is afhankelijk van de vorm van oestrogeen en van de aanwezigheid van oestrogeenreceptoren.
Vormen van oestrogeen
Er zijn verschillende vormen van oestrogeen. De belangrijkste zijn oestron, oestradiol, oestriol en oestetrol (zie kader). Ze worden in het lichaam onder invloed van metabole en biochemische omstandigheden omgezet in verschillende afbraakproducten (metabolieten). Ze worden geïnactiveerd door binding aan glucuronzuur of sulfaat en kunnen ook weer vrijgemaakt (geactiveerd) worden uit deze verbindingen.
De geslachtshormonen kunnen in het bloed ook gebonden worden aan sekshormoon bindend globuline (SHBG). SHBG verhindert dat de androgenen en oestrogenen hun receptoren activeren. Aan de andere kant vertraagt het de afbraak van de geslachtshormonen en zorgt het ervoor dat testosteron en oestrogeen beschikbaar blijven. Het voorkomt dus een gebrek aan geslachtshormonen en het beschermt tegelijkertijd tegen te veel actief testosteron en oestrogeen (Hammond GL, 2016).
Factoren die sekshormoon bindend globuline (SHBG) verlagen
- insulineresistentie, hyperinsulinemie (te veel insuline in het bloed)
- hoge bloedsuikerspiegel (hyperglycemie)
- overgewicht
- gebrek aan schildklierhormoon (hypothyreoïdie)
- chronische inflammatie
- gebrek aan vitamine D
Factoren die sekshormoon bindend globuline (SHBG) verhogen
- omega-3 vetzuren
- lignanen (vlaszaad, sesamzaad)
- vitamine D
- resveratrol, rode wijn
- beweging
- ontstekingsremmers
- metformine (diabetesmedicijn)
Vraag gratis video consult aan! (t.w.v. €195)
Oestrogeenreceptoren
Tijdens de (peri)menopauze kan de activiteit van oestrogeen verhoogd zijn, ondanks de gangbare opinie dat er een gebrek aan oestrogeen is en ondanks het feit dat postmenopauzale vrouwen symptomen van een gebrek aan oestrogeen hebben. Deze schijnbare paradox kan verklaard worden door een verstoorde activiteit van de oestrogeenreceptoren.
Oestrogeen werkt door het activeren van oestrogeenreceptoren (ontvangers) op de cellen. De twee meest onderzochte oestrogeenreceptoren zijn ER-alfa en ER-bèta (ER staat voor estrogen receptor). Ze zijn in alle organen en weefsels aanwezig, vooral in de voortplantingsorganen, de borsten, de botten, de lever, het hart, de longen en de hersenen. De verschillende vormen van oestrogeen hebben een andere affiniteit voor ER-alfa dan voor ER-bèta, dat wil zeggen dat ze meer of minder geneigd zijn om op ER-alfa of ER-bèta te binden (zie kader). Oestradiol heeft evenveel affiniteit voor ER-alfa als voor ER-bèta.
ER-alfa is het meest actief in de voortplantingsorganen, de borsten en in de hersenen. ER-alfa stimuleert de proliferatie van cellen (vermenigvuldiging door celdeling). Dat is nodig voor de voortplanting, voor groei en voor weefselherstel. Overmatige activatie van deze receptor verhoogt het risico op oestrogeengevoelige aandoeningen en kankers.
ER-bèta is het meest actief in de botten, het hart, de hersenen en de longen. ER-bèta remt de proliferatie van cellen. Activatie van deze receptor gaat de celgroeistimulerende effecten van oestrogeen tegen en vermindert het risico op oestrogeengevoelige aandoeningen en kankers.
Er is recent nog een derde oestrogeenreceptor ontdekt, namelijk een membraanreceptor (GPER1). Deze receptor wordt – voor zover men weet – alleen geactiveerd door oestradiol.
Verstoorde activiteit van oestrogeen
De verschillende vormen van oestrogeen (en alle afbraakproducten ervan) hebben een ander effect. Het effect van oestrogeen is vooral afhankelijk van de aanwezigheid en de activiteit van de oestrogeenreceptoren. In normale omstandigheden wordt de activiteit van oestrogeen in verschillende weefsels strikt geregeld door deze receptoren.
ER-alfa is even belangrijk als ER-bèta, ook al wordt hij vaak als een ‘slechte’ receptor beschreven, die geremd moet worden. Een verhoogde activiteit van ER-alfa kan bijvoorbeeld een teken zijn van chronische weefselschade en een verhoogde noodzaak aan groei- en herstelfactoren, waarvan de aanmaak en de activiteit door ER-alfa gereguleerd wordt.
Een verhoogde of verlaagde activiteit van oestrogeenreceptoren is betrokken bij het ontstaan van hormonale en metabole aandoeningen. De activiteit van oestrogeenreceptoren is heel complex en er is nog heel veel onduidelijkheid over de verschillende effecten ervan (Zhu BT, 2006; Fuentes N, 2019).
Een verhoogde activiteit van ER-alfa in onder andere de borsten en de voortplantingsorganen en een verlaagde activiteit van ER-bèta in onder andere de botten, de hersenen en de bloedvaten is gelinkt aan hormonale aandoeningen en kankers, hart- en vaatziekten, menopauzeklachten en de symptomen van een ‘gebrek aan oestrogeen’. Het gaat niet om de oestrogeenwaarden op zich, maar om de activiteit van oestrogeen in verschillende weefsels, die afhankelijk is van de aanwezigheid en de activiteit van oestrogeenreceptoren in die weefsels.
Vrouwen met overgewicht hebben tijdens de menopauze vaak verhoogde oestrogeenwaarden. Toch hebben ze vaak ernstigere menopauzeklachten dan vrouwen zonder overgewicht (Fernández-Alonso AM, 2010).
Regelmatig matig tot intensief bewegen verlaagt de oestrogeenwaarden in het bloed, ook bij (postmenopauzale) vrouwen die oestrogeensupplementen nemen. Hoe meer beweging, hoe lager de oestrogeenwaarden (Choudhury F, 2011). Toch is meer beweging juist gelinkt aan minder menopauzeklachten (Sternfeld B, 2011). Een daling van oestrogeen in het bloed is dus op zich niet de oorzaak van menopauzeklachten.
Verhoogde aanmaak van oestrogeen
Tijdens de menopauze wordt er bijna geen oestrogeen meer aangemaakt door de eierstokken, maar wordt er nog wel oestron of oestradiol aangemaakt uit androgenen (androsteendion en testosteron) in andere weefsels, vooral in de bijnieren en in vetweefsel. Oestron kan omgezet worden in oestradiol in onder andere vetweefsel, borstweefsel, de huid, de botten, de hersenen, de bloedvaten en de gladde spiercellen.
De aanmaak van voldoende oestrogeen na de menopauze is belangrijk voor de botten, de huid, de bloedvaten en de hersenen, maar de aanmaak en de activiteit van oestrogeen kan ook te hoog zijn, wat de groei van oestrogeengevoelige weefsels en tumoren stimuleert.
De aanmaak van oestrogeen uit androgenen wordt geregeld door het enzym aromatase, dat aanwezig is in de voortplantingsorganen, de borsten, de bijnieren, de lever, de huid, de spieren, de bloedvaten, de botten en de hersenen. De activiteit van aromatase mag niet te laag zijn, maar ook niet te hoog.
De activiteit van aromatase wordt beïnvloed door verschillende factoren. Aromatase wordt geactiveerd door overgewicht, te veel buikvet, het hormoon insuline, een hoge inname van koolhydraten, suikers en zuivel, en te veel alcohol. Al deze factoren verhogen de aanmaak van oestrogeen.
Farmaceutische aromatase remmers (medicijnen die de werking van aromatase remmen en die onder andere voorgeschreven worden bij borstkanker) blokkeren de aanmaak van oestrogeen en veroorzaken typische menopauzeklachten.
De activiteit van aromatase moet gemoduleerd worden, zodat er voldoende oestrogeen aangemaakt wordt, maar niet te veel. Dat kan door in de eerste plaats de oorzaken van een verhoogde activiteit van aromatase aan te pakken met voeding en leefstijl. Er zijn ook voedingsstoffen die aromatase moduleren.
Ze werken op een andere manier dan farmaceutische aromatase remmers, door in te werken op de onderliggende oorzaken van een te hoge activiteit van aromatase (zie kaders). Stoffen zoals soja-isoflavonen, resveratrol en quercetine worden beschouwd als natuurlijke selectieve aromatase modulators.
Ze remmen een overmatige activiteit van aromatase in bepaalde weefsels (bv. in borsttumoren), zonder de aanmaak van oestrogeen in alle weefsels te blokkeren (Khan SI, 2011; Lephart ED, 2015).
Factoren die aromatase verhogen
- te veel buikvet, overgewicht
- chronische inflammatie
- te veel insuline, insulineresistentie
- te veel geraffineerde koolhydraten, suikers, zuivel
- te veel alcohol
Natuurlijke selectieve aromatase modulators
- fyto-oestrogenen, isoflavonen, lignanen
- resveratrol, quercetine, EGCG, curcumine
- citrusflavonoïden, apigenine, luteoline, chrysine
- vitamine D
- melatonine
- rode wijn (met mate)
- granaatappelextract
- hop (Humulus lupulus)
- Fucus vesiculosus (bruinwier)
Oestrogeen in de hersenen
Oestrogeenreceptoren in de hersenen spelen een rol in verschillende lichaamsfuncties, ook in de werking van de hersenen zelf. In de hersenen zijn zowel ER-alfa als ER-bèta aanwezig. Ze zijn allebei even belangrijk, ze mogen niet te actief of inactief zijn.
Activatie van ER-bèta in de hersenen heeft een angstremmende, antidepressieve werking en remt de stressrespons. Activatie van ER-alfa doet het omgekeerde, het verhoogt de stressrespons en heeft een angstopwekkende werking. Een verlaagde activiteit van ER-bèta en/of een verhoogde activiteit van ER-alfa ligt aan de basis van menopauzeklachten zoals opvliegers, angst, depressie en een verhoogde gevoeligheid voor stress (Weiser MJ, 2008; Handa RJ, 2012).
Suppletie met oestrogeen (17-bèta-oestradiol) verhoogt het aantal ER-alfa receptoren in de hersenen en verlaagt het aantal ER-bèta receptoren (Prange-Kiel J, 2003).
Effecten van activatie van de oestrogeenreceptor ER-bèta in de hersenen
- moduleert de hypothalamus-hypofyse-bijnier as
- tempert de stressrespons, verlaagt de aanmaak en vrijgave van (nor)adrenaline en cortisol in respons op stress
- verhoogt de aanmaak van serotonine en dopamine
- heeft een angstremmende werking
- heeft een antidepressieve werking
- stimuleert de aanmaak van nieuwe hersencellen
- remt ontsteking in de hersenen (neuro-inflammatie)
- verbetert het geheugen en de verstandelijke functies
- verbetert de thermoregulatie (vermindert opvliegers)
Verlaagde activiteit van progesteron
Na de menopauze stopt de aanmaak van progesteron door de eierstokken en wordt progesteron vooral aangemaakt in de bijnieren en in de hersenen.
Het effect van progesteron is net als dat van oestrogeen afhankelijk van de soort receptor die geactiveerd wordt. Er zijn twee progesteronreceptoren, PR-A en PR-B, die een ander effect hebben, samenwerken of elkaar tegenwerken.
Progesteron heeft uiteenlopende functies in heel het lichaam (zie boven). Progesteronreceptoren zijn aanwezig in verschillende weefsels, onder andere de eierstokken, de baarmoeder, de borstklieren, de hersenen, de botten, de urinewegen en de pancreas (en vermoedelijk in nog meer weefsels).
In gezonde weefsels is ongeveer evenveel PR-A als PR-B actief, terwijl in weefsels met goedaardige of kwaadaardige woekering (bv. endometriose, baarmoederfibromen, borstkanker) een van de twee receptoren overactief is en de andere inactief (Scarpin KM, 2009).
Recent is nog een derde progesteronreceptor ontdekt, een membraanreceptor, die niet alleen een rol speelt in de voortplanting, maar ook in het centraal zenuwstelsel en het immuunsysteem (Dressing GE, 2011).
De activiteit van progesteron en progesteronreceptoren is heel complex en nog minder goed begrepen dan de activiteit van oestrogeenreceptoren.
Progesteron en oestrogeen werken samen en hebben in veel weefsels een tegengestelde of een complementerende werking. Oestrogeen activeert bijvoorbeeld de botafbraak (die nodig is voor de aanmaak van nieuw botweefsel) en progesteron stimuleert de botopbouw.
In de hersenen heeft oestrogeen vooral een stimulerend effect, terwijl progesteron een kalmerend effect heeft, de slaap verbetert en angst remt. Oestrogeen stimuleert de groei van hormoongevoelige weefsels, terwijl progesteron de groei afremt. Te veel oestrogeen in verhouding tot progesteron is een belangrijke oorzaak van menopauzeklachten en hormonale aandoeningen en kankers.
Het verhogen van progesteron of de activiteit van progesteron wordt door sommige onderzoekers beschouwd als een betere en veiligere therapie voor het behandelen van menopauzeklachten dan suppletie met oestrogeen of de combinatie oestrogeen/progesteron (Prior JC, 2011).
Suppletie met bio-identiek progesteron is vaak doeltreffend voor het verlichten van menopauzeklachten, maar het herstellen van de verhouding tussen oestrogeen en progesteron – door het verlagen van een te hoge oestrogeenaanmaak met voeding en leefstijl – is een betere manier (zie boven). Een van de belangrijkste oorzaken van een verstoorde balans tussen oestrogeen en progesteron is overgewicht.
De activiteit van progesteron kan ook verhoogd worden door bepaalde voedingsstoffen (zie kader).
Progesteron verhogende/modulerende stoffen
- vitamine C
- rode klaver extract (trifolium pratense)
- vitex agnus castus (monnikspeper, kuisboom)
- hop (Humulus lupulus)
- soja-isoflavonen (genisteïne, daidzeïne)
- resveratrol, quercetine, curcumine, EGCG (groene thee), kampferol, apigenine, naringenine
Een van de belangrijkste oorzaken van een verstoorde balans tussen oestrogeen en progesteron is overgewicht.
Gebrek aan testosteron
Testosteron, het zogenaamde mannelijke hormoon, is ook essentieel voor de gezondheid van vrouwen. Het is de grondstof voor de aanmaak van oestrogeen, maar het regelt ook zelf verschillende lichaamsfuncties.
Verschillende klachten tijdens de (peri)menopauze – zoals een verminderd libido, spierverlies, meer vet rond de taille en vaginale droogte – kunnen ook het gevolg zijn van een gebrek aan testosteron (Schwenkhagen A, 2007).
Een van de oorzaken van een gebrek aan testosteron en te veel oestrogeen in verhouding tot testosteron is een verhoogde activiteit van aromatase. Aromatase zet testosteron (of androsteendion) om in oestrogeen, zodat er minder testosteron en meer oestrogeen beschikbaar is (zie boven).
Suppletie met testosteron kan bij vrouwen met een gebrek aan testosteron menopauzeklachten verlichten, maar het doet niets aan de onderliggende oorzaken van een gebrek aan testosteron. Het afremmen of moduleren van aromatase met voeding, leefstijl en voedingssupplementen is een betere manier om de verhouding tussen testosteron en oestrogeen (en tussen progesteron en oestrogeen) te herstellen.
Functies van testosteron bij vrouwen
- aanmaak van oestrogeen
- aanmaak en rijping van eicellen
- nodig voor een gezond libido
- spiergroei, spierkracht
- botgroei
- vetverbranding
- aanmaak van rode bloedcellen (erytropoëse)
- groei van zenuwcellen
- bescherming van zenuwcellen (tegen oxidatieve stress, neurotoxische stoffen, amyloid-bèta, …)
- belangrijk voor de verstandelijke functies, aandacht, geheugen en ruimtelijk inzicht
- remt ontsteking
Mogelijke gevolgen van een gebrek aan testosteron bij vrouwen
- verminderd libido
- depressie, angst
- verlies van spiermassa en spierkracht
- meer buikvet
- haarverlies
- vermoeidheid, gebrek aan energie (mentaal en fysiek)
- achteruitgang van de verstandelijke functies
Nutriënten die de activiteit van testosteron verhogen
- Tribulus terrestris
- ashwagandha (Withania somnifera)
- Panax ginseng
- maca (Lepidium peruvianum)
Te veel dihydrotestosteron
Testosteron kan ook omgezet worden in dihydrotestosteron (DHT) dat een sterkere werking heeft. Bij een verhoogde omzetting van testosteron naar DHT (door een verhoogde activiteit van het enzym 5-alfa-reductase) kunnen de testosteronwaarden in het bloed verlaagd of normaal zijn, maar kan er te veel DHT in de cellen actief zijn. Te veel DHT is bij vrouwen gelinkt aan overmatige haargroei in het gezicht en op het lichaam en haaruitval op het hoofd (Swerdloff RS, 2017).
Oorzaken van een verhoogde activiteit van 5-alfa-reductase (te veel DHT)
- insulineresistentie, hyperinsulinemie (te veel insuline in het bloed)
- te veel insulineachtige groeifactor (IGF-1)
- een hoge inname van geraffineerde koolhydraten, suikers en zuivel (verhoogt de aanmaak van insuline en IGF-1)
- een gebrek aan het omega-6 vetzuur gamma-linoleenzuur (GLA)
- een gebrek aan het omega-3 vetzuur eicosapentaeenzuur (EPA)
- een gebrek aan flavonoïden (groenten, fruit, kruiden, specerijen, noten, zaden, peulvruchten, …)
Natuurlijke 5-alfa-reductase modulators
- polyfenolen, flavonoïden: groene thee polyfenolen (EGCG), quercetine, myricetine, baicaleïne, kampferol, fisetine, isoflavonen, genisteïne
- vitamine B2 (riboflavine)
- omega-3 vetzuren (EPA)
- gamma-linoleenzuur (GLA)
- lignanen (vlaszaad)
- zaagpalmetto (Serenoa repens)
- pompoenpitten (Cucurbita pepo)
- lycopeen (tomaten)
- reishi (Ganoderma lucidum)
Opvliegers
Het klassieke symptoom van de perimenopauze is de opvlieger, die door de meeste vrouwen in mindere of meerdere mate ervaren wordt en bij ongeveer een derde van de vrouwen problematisch is. Doorgaans heeft men gedurende één tot twee jaar perioden met opvliegers, maar sommige vrouwen hebben er tien jaar of langer last van en bij een klein percentage gaan ze nooit meer helemaal weg.
Opvliegers komen ook al voor in de premenopauze, voor men in de eigenlijke overgang komt, maar ze zijn dan licht van aard en worden vaak niet als opvliegers herkend. Ze komen vaker voor wanneer men in de overgang komt en worden erger en frequenter naarmate de periode tussen de menstruaties langer duurt. Bij de meeste vrouwen worden de perioden met opvliegers afgewisseld met perioden zonder opvliegers.
Men weet nog steeds niet hoe opvliegers juist veroorzaakt worden. Hoewel ze toegeschreven worden aan een daling van oestrogeen, is er geen verband tussen oestrogeenwaarden in het bloed en opvliegers. Het heeft vermoedelijk meer te maken met de activiteit van de oestrogeenreceptoren.
Tamoxifen, een anti-oestrogeen medicijn dat de oestrogeenreceptoren in verschillende weefsels blokkeert, veroorzaakt opvliegers en andere typische menopauzeklachten, zoals gewichtstoename, vaginale droogte, slapeloosheid en gewrichtspijn (Moon Z, 2017). Het verlaagt de oestrogeenwaarden niet, maar wijzigt de werking van oestrogeen. Langdurig gebruik van tamoxifen verhoogt zelfs de oestrogeenwaarden in het bloed (Lum SS, 1997).
Een belangrijk mechanisme bij opvliegers is een verstoorde thermoregulatie. Oestrogeen speelt een rol in het reguleren van de lichaamstemperatuur. Activatie van de oestrogeenreceptoren in een bepaald deel van de hersenen doet de bloedvaten in de huid uitzetten om warmte af te voeren en de kerntemperatuur van het lichaam af te koelen.
Bij een gebrek aan oestrogeen in de hersenen – of een verlaagde activiteit van de oestrogeenreceptoren – wordt de thermoregulatie ontregeld, waardoor de kerntemperatuur van het lichaam sneller stijgt wanneer de omgevingstemperatuur of het metabolisme stijgt (vb. in een warme kamer of tijdens lichamelijke inspanningen), zodat men sneller en meer gaat zweten dan normaal.
Tijdens een opvlieger kan de huid warm en rood worden door het uitzetten van de bloedvaten in de huid (vooral in het gezicht, in de nek, op de borst en op de rug). Dit kan ook gepaard gaan met een versnelde hartslag, een verlaagde bloeddruk en een verminderde bloedtoevoer naar de hersenen (Charkoudian N, 2003).
Een verlaagde activiteit van de oestrogeenreceptoren in de hersenen verhoogt de activiteit van de neurotransmitter noradrenaline. Dit stimuleert het sympathisch zenuwstelsel (de stressrespons), wat onder andere een snellere hartslag, overmatig zweten en angst kan veroorzaken.
Volgens sommige onderzoekers zijn opvliegers een gevolg van een verstoorde stressrespons, namelijk een overactief sympathisch zenuwstelsel (stress) dat niet voldoende gebufferd wordt door het parasympathisch zenuwstelsel (rust) (Thurston RC, 2012; Lee JO, 2011).
Het activeren van het parasympathisch zenuwstelsel (via de nervus vagus) door ontspanning, stressvermindering en regelmatig bewegen kan een overactief sympathisch zenuwstelsel verlagen. Dat verklaart waarom voedingsstoffen en planten die de stressrespons temperen het aantal en de ernst van opvliegers kunnen verminderen (zie kader).
Ook relaxatietechnieken die noradrenaline remmen, zoals langzaam en diep ademen, verminderen de frequentie en de intensiteit van opvliegers (Freedman RR, 2005).
Oestrogeen regelt ook de activiteit van serotonine, een neurotransmitter die eveneens betrokken is bij de regulatie van de lichaamstemperatuur, maar ook nodig is voor een gezond slaappatroon en een goed gevoel. Dat gebeurt via activatie van de oestrogeenreceptor ER-bèta (Pestana-Oliveira N, 2018).
De verstoorde activiteit van serotonine als gevolg van een verlaagde activiteit van ER-bèta kan de link tussen opvliegers, slaapproblemen, depressie en stemmingswisselingen verklaren.
Suppletie met oestrogeen (17-bèta-oestradiol) is doeltreffend voor het verminderen van opvliegers, maar het activeert ook ER-alfa en dat verhoogt het risico op hormonale kankers. Stoffen die vooral ER-bèta activeren en in veel mindere mate ER-alfa (zoals fyto-oestrogenen en andere oestrogeenreceptor modulators) zijn een veelbelovend veilig alternatief voor hormoonsubstitutie therapie voor het verminderen van de frequentie en de ernst van opvliegers (Jarry H, 2013; McGregor C, 2014).
Factoren die opvliegers verergeren
- overgewicht
- insulineresistentie
- anti-oestrogeen therapie
- het verwijderen van de eierstokken
- een gebrek aan nutriënten (vitamine D, vitamine E, foliumzuur, vitamine B6, vitamine C, magnesium, omega-3 vetzuren, …)
- stress, verhoogde stressrespons, overactief sympathisch zenuwstelsel
Factoren die opvliegers verminderen
- fyto-oestrogenen
- omega-3 vetzuren (EPA en DHA)
- vitamine C, vitamine E
- foliumzuur
- magnesium
- saffraan (Crocus sativus)
- ginseng (Panax ginseng)
- maca (Lepidium peruvianum)
- schisandra (Schisandra chinensis)
- dong quai (Angelica sinensis)
- black cohosh (Cimicifuga racemosa)
- valeriaan (Valeriana officinalis)
- passiebloem (Passiflora incarnata)
- sint-janskruid (Hypericum perforatum)
- regelmatig matig-intensieve beweging
- relaxatietechnieken, mind-body technieken
Vraag gratis video consult aan! (t.w.v. €195)
Vaginale droogte
Een veelvoorkomende klacht van vrouwen tijdens en na de menopauze is vaginale droogte, een van de kenmerken van vulvovaginale atrofie, het dunner en droger worden van de vaginawand en de schaamlippen. Oestrogeen en progesteron zorgen voor gezonde slijmvliezen en een gezonde microflora in de vagina. Bij een gebrek aan oestrogeen en/of progesteron worden de slijmvliezen in de vagina afgebroken (atrofie), wat gepaard gaat met droogte, irritatie, jeuk, pijn tijdens het vrijen, vaginale infecties, urineweginfecties en incontinentie.
De vaginale flora speelt hierin een belangrijke rol. Een gezonde vaginale flora is rijk aan lactobacillen (onder andere L. jensenii, L. crispatus en L. gasseri) en heeft een lage bacteriële diversiteit (weinig verschillende soorten bacteriën). Vrouwen met een gezonde vaginale flora hebben minder last van vaginale droogte dan vrouwen met minder lactobacillen en een hogere bacteriële diversiteit (Hummelen R, 2011).
Suppletie met orale of vaginale probiotica (vooral lactobacillen) wordt beschouwd als een doeltreffend en veilig alternatief voor hormoonsubstitutie voor het voorkomen of behandelen van vaginale droogte (Muhleisen AL, 2016).
Factoren die vaginale atrofie verminderen (oraal, zalf of zetpillen)
- probiotica (vooral lactobacillen)
- fyto-oestrogenen
- soja-isoflavonen
- duindoornolie (Hippophae rhamnoides)
- vitamine D, vitamine E
- zink
- Tribulus terrestris
- ashwagandha (Withania somnifera)
Slapeloosheid
Vrouwen krijgen vaker slaapproblemen na hun vijfenveertigste en dit wordt heel vaak toegeschreven aan de (peri)menopauze, maar het is niet altijd duidelijk of het een gevolg is van hormonale schommelingen of van ouder worden.
Toch wordt slapeloosheid als een symptoom van de overgang en menopauze beschouwd, omdat het gelinkt is aan opvliegers. Vrouwen met frequentere en ernstigere opvliegers melden vaker slaapproblemen dan vrouwen zonder opvliegers (Baker FC, 2018). Opvliegers en nachtelijk zweten kunnen ervoor zorgen dat men minder goed slaapt, maar er is wellicht ook een verband met de bovengenoemde verstoorde activiteit van serotonine door een verlaagde activiteit van ER-bèta. Soja-isoflavonen, die ER-bèta activeren, verbeteren slapeloosheid bij vrouwen in de postmenopauze (Hachul H, 2011).
Factoren die slapeloosheid tijdens de (peri)menopauze verminderen
- soja-isoflavonen
- resveratrol
- vitamine E
- valeriaan (Valeriana officinalis)
- citroenmelisse (Melissa officinalis)
- passiebloem (Passiflora incarnata)
- black cohosh (Cimicifuga racemosa)
- tryptofaan
- melatonine
Slapeloosheid wordt besproken in PlaceboNocebo 21.
Angst & depressie
Angst en depressie komen heel veel voor bij vrouwen in de overgang en worden erger in de late fase van de perimenopauze, wanneer de perioden zonder maandstonden langer worden.
De sterke schommelingen van oestrogeen tijdens de perimenopauze maken vrouwen emotioneel gevoeliger voor stressvolle levensgebeurtenissen en psychosociale stress (echtscheiding, verlies van een geliefde, ziekte van een geliefde, ontslag, financiële problemen, eigen ziekte of ongeluk) en vooral voor sociale stress (gebrek aan sociale steun, zich afgewezen voelen).
Vrouwen die geen ernstige stressvolle gebeurtenissen meemaken of geen psychosociale stress hebben, hebben minder kans om tijdens de menopauze depressief te worden (Gordon JL, 2016).
Activatie van ER-bèta door oestrogeen is belangrijk voor de aanmaak van nieuwe hersencellen, het moduleert de neurale en hormonale regulatie van de stressrespons, het regelt de activiteit van serotonine en dopamine, het beschermt de hersencellen tegen inflammatie en het vermindert angst en depressie. Een gebrek aan oestrogeen of aan andere stoffen die ER-bèta activeren veroorzaakt neuro-inflammatie, angst en depressie. Het activeren van ER-bèta wordt beschouwd als een nieuwe manier om angst en depressie te behandelen, vooral bij vrouwen (Vargas KG, 2016; Kobayashi M, 2016; Xu Y, 2016).
Stoffen die ER-bèta activeren of oestrogeenreceptor modulators, zoals fyto-oestrogenen en resveratrol, kunnen depressie verlichten bij vrouwen in de (post)menopauze (Fattah A, 2017; Davinelli S, 2017).
Factoren die angst en depressie tijdens de (peri)menopauze verminderen
- omega-3 vetzuren
- fyto-oestrogenen
- resveratrol
- vitamine D
- saffraan (Crocus sativus)
- sint-janskruid (Hypericum perforatum)
- rozenwortel (Rhodiola rosea)
- black cohosh (Cimicifuga racemosa)
Angst & depressie worden besproken in PlaceboNocebo 37.
Het belang van ER-bèta
Activatie van ER-bèta is niet alleen belangrijk in de hersenen, maar heeft ook veel andere gunstige cellulaire en metabole effecten. De activatie van ER-bèta speelt een sleutelrol in het voorkomen of verminderen van menopauzeklachten en het voorkomen of verminderen van metabole stoornissen tijdens en na de menopauze (Ponnusamy S, 2017; Velders M, 2012; Zhao L, 2018; Muka T, 2016; Campbell L, 2010; Tagliaferri MA, 2016).
Cellulaire & metabole effecten van activatie van ER-bèta
- verhoogt de energieaanmaak in cellen (verbetert de mitochondriale functie)
- verhoogt het energieverbruik in rust
- verhoogt de aanmaak van bruin vet, verhoogt de vetverbranding
- voorkomt overgewicht, helpt bij gewichtsverlies
- stimuleert spiergroei en spierregeneratie
- heeft een ontstekingsremmende en pijnstillende werking
- moduleert de immuniteit
- remt overmatige immuun- en ontstekingsreacties (allergie, auto-immuniteit)
- verhoogt de immuniteit tegen virussen, bacteriën en kankercellen
- remt de groei van kankercellen (alle vormen van kanker)
- onderdrukt de groei van oestrogeengevoelige weefsels en tumoren
- verwijdt de bloedvaten, voorkomt hoge bloeddruk
- voorkomt plaquevorming, atherosclerose
- remt huidveroudering
- stimuleert wondgenezing
- vermindert de frequentie en de ernst van opvliegers
- vermindert angst en depressie
- verbetert het geheugen
Factoren die ER-bèta activeren
- fyto-oestrogenen
- isoflavonen: genisteïne, daidzeïne, equol
- lignanen (vlaszaad, sesamzaad)
- coumestrol (rode klaver, alfalfakiemen, peulvruchten)
- liquiritigenine (Glycyrrhiza glabra, zoethoutwortel)
- silybinine (Silybum marianum, mariadistel)
- ginsenosiden (Panax ginseng)
- polyfenolen: resveratrol, quercetine, naringenine, apigenine, …
Fyto-oestrogenen
Fyto-oestrogenen zijn stoffen in plantaardige voeding met een gelijkaardige structuur als oestrogeen (17-bèta-oestradiol), maar met een heel andere werking. Ze hebben een oestrogene of een anti-oestrogene werking, afhankelijk van de omstandigheden. Ze hebben bijvoorbeeld een oestrogene werking als er te weinig oestrogeen beschikbaar is en een anti-oestrogene werking als er te veel oestrogeen aanwezig is. Ze hebben een grotere affiniteit voor de oestrogeenreceptor ER-bèta dan voor ER-alfa. Dat wil zeggen dat ze meer geneigd zijn om te binden op ER-bèta en de activiteit van ER-alfa eerder afremmen, hoewel ze bij een gebrek aan oestrogeen ook ER-alfa kunnen activeren (Hsieh CJ, 2018).
Fyto-oestrogenen reguleren niet alleen de activiteit van oestrogeen, maar ook van androgenen (testosteron en dihydrotestosteron) en progesteron. Ze hebben een androgene of anti-androgene werking en een progestogene of anti-progestogene werking, afhankelijk van de situatie en het soort weefsel. Ze moduleren ook de activiteit van enzymen die betrokken zijn bij de aanmaak en de afbraak van oestrogeen, testosteron en progesteron (Dean M, 2017).
De bekendste fyto-oestrogenen in de voeding zijn isoflavonen, lignanen, coumestanen, stilbenen, flavonoïden en zwavelhoudende stoffen in crucifere groenten (zie artikel op pagina 22).
Hormoon modulators
Fyto-oestrogenen worden beschouwd als natuurlijke selectieve oestrogeenreceptor modulators (SERM’s). SERM’s kunnen zowel op ER-alfa als op ER-bèta binden en de oestrogeenreceptoren in staat stellen om te binden met de cofactoren die hun werking activeren of remmen, afhankelijk van het soort weefsel en de metabole omstandigheden (Jordan VC, 2001).
Er zijn nog andere stoffen die de werking van oestrogeen, androgeen en progesteron reguleren, onder andere vitamine D, vitamine E, omega-3 vetzuren en gamma-linoleenzuur (GLA). Er worden steeds meer voedingsstoffen ontdekt die strikt gezien niet tot de fyto-oestrogenen behoren en toch de werking van hormonen en hormoonreceptoren moduleren, zoals curcumine, EGCG uit groene thee, isothiocyanaten (uit broccoli en waterkers) en adaptogenen (zoals ginseng en rhodiola).
Ze verminderen niet alleen menopauzeklachten, maar voorkomen ook hormonale aandoeningen, hormonale kankers, osteoporose, hart- en vaatziekten en achteruitgang van de verstandelijke functies.
In de artikels op pagina 22 en 32 worden de effecten van deze stoffen bij menopauzeklachten uitgebreid besproken.
Natuurlijke selectieve oestrogeenreceptor modulators
- soja-isoflavonen (genisteïne, daidzeïne, equol)
- lignanen (vlaszaad, sesamzaad, hennepzaad)
- resveratrol (druiven, rode wijn, bessen, pinda’s, pistachenoten)
- quercetine (druiven, rode wijn, bessen, uien, appels)
- kampferol (uien, boerenkool, broccoli, spruiten, spinazie, appels, bessen, druiven, groene thee)
- ellaginezuur (granaatappel, bessen, frambozen, aardbeien, groenten, fruit, walnoten)
- EGCG (groene thee, zwarte thee, bessen)
- isothiocyanaten (broccoli, koolsoorten, spruiten, waterkers)
- curcumine (kurkuma)
- vitamine D (zonlicht)
- vitamine E (noten, zaden, plantaardige olie)
- omega-3 vetzuren (vette vis, vlaszaadolie, walnoten, noten, zaden)
- gamma-linoleenzuur (teunisbloemolie, borageolie)
- melatonine
- rode klaver (Trifolium pratense)
- hop (Humulus lupulus)
- zoethoutwortel (Glycyrrhiza glabra)
- rozenwortel (Rhodiola rosea)
- ginseng (Panax ginseng)
- black cohosh (Cimicifuga racemosa)
Effecten van natuurlijke selectieve oestrogeenreceptor modulators
- verminderen menopauzeklachten
- verminderen opvliegers
- verminderen angst en depressie
- verbeteren het geheugen en de verstandelijke functies
- verlagen het risico op hormonale kankers
- voorkomen overgewicht
- verlagen het risico op hart- en vaatziekten
- voorkomen osteoporose
Metabole oorzaken van menopauzeklachten
Hoewel een verstoorde activiteit van oestrogeen en progesteron een belangrijke factor is bij menopauzeklachten, is de eigenlijke oorzaak van deze verstoorde hormonale activiteit niet de perimenopauze of menopauze zelf, maar een verkeerd voedingspatroon en een ongezonde leefstijl.
De drie belangrijkste metabole stoornissen die gelinkt zijn aan menopauzeklachten zijn overgewicht, insulineresistentie en een hoge bloedsuikerspiegel (diabetes). Het zijn de belangrijkste oorzaken van hormonale stoornissen.
Menopauzale vrouwen met overgewicht, insulineresistentie en diabetes hebben meer androgenen en oestrogenen in hun bloed dan vrouwen met een normaal gewicht en zonder metabole aandoeningen. Toch hebben ze meer last van menopauzeklachten (Verhaeghe J, 2009; Fernández-Alonso AM, 2010; Koo S, 2017; Yim G, 2015; Rouen PA, 2015; Jackson SL, 2005).
Overgangsklachten zijn goed te behandelen met voeding
Soms zie je vrouwen in de overgang in een half jaar oud worden. Ze slapen slecht, hebben last van stemmingswisselingen, opvliegers, hoofdpijn, gewrichtsklachten, opvliegers en overmatig zweten. En je ziet de rimpels zo in het gezicht trekken……..
Uit onderzoek blijkt echter dat primitieve stammen die natuurlijk eten en leven geen last hebben van overgangsklachten! Met andere woorden: Deze periode die voor veel vrouwen een gruwel is, kan dus klachtenvrij zijn! Lees ook de ervaring van Nel.

Een klachtenvrije overgang
Hoe kom je de overgang klachtenvrij door? Als je weinig tot niks wilt merken van je overgang, kun je je daarop voorbereiden. De klachten die gepaard gaan met de overgang zijn namelijk vaak een gevolg van de huidige voeding, leefstijl en overgewicht. En hoe zit dan dan precies?

Suiker
Suikers in het bloed zijn een trigger voor verschillende overgangsklachten, zoals opvliegers en zweten. Het consumeren van suiker veroorzaakt of verergert de klachten. Doordat suikers veel insulinepieken veroorzaken, raakt de hormoonhuishouding uit balans.
Suikers zitten niet alleen in taart, snoep of koek. Het zit in de meeste fabrieksmatige voeding in de supermarkt, zoals in zakjes en pakjes en kant-en-klare voeding. Maar ook brood, pasta en aardappelen worden omgezet tot suiker. Wanneer je de inname van suikers zoveel mogelijk beperkt, zul je ook minder last meer hebben van onder andere vervelende opvliegers.
Een gezond gewicht
Gewichtsverlies zorgt ervoor dat de meeste overgangsklachten verminderen. Vooral opvliegers nemen hierdoor af. Een andere/gematigde eetstijl zorgt ook voor onder andere een betere nachtrust, minder gewrichtsklachten en een betere hormoonbalans.
Koffie en alcohol
Uit onderzoek blijkt dat vrouwen die koffie en/of alcohol drinken meer last hebben van opvliegers en nachtzweten. Alcohol kan naast opvliegers ook een slechte nachtrust en een slechter herstel veroorzaken.

Eetmomenten
Ook zijn er aanwijzingen dat meerdere eetmomenten en een overschot aan koolhydraten in de voeding de progesteron-aanmaak verminderen. 2-3 eetmomenten wordt op dit moment vaker als ideaal gezien dan 5-6 keer een maaltijd danwel een tussendoortje.
Hormonen in balans
De klachten die gepaard gaan met de overgang zijn meestal ook hormoon-gerelateerd. Wanneer het hormoon progesteron daalt kan de oestrogeen-productie tijdelijk toenemen om dit evenwicht op te vangen. Er ontstaat oestrogeen-dominantie. Pas later zal het oestrogeen-niveau geleidelijk aan verminderen, tot er weinig tot niets meer wordt aangemaakt in de eierstokken. Het gevolg daarvan is dat de menstruatie onregelmatig wordt en op een gegeven moment niet meer optreedt. Oestrogenen zijn echter belangrijk voor een goede gezondheid. In de reguliere geneeskunde gaat men er vanuit dat klachten in en rond de menopauze vooral komen door een verminderde oestrogeen-productie. Maar oestrogeen-dominantie kan een oorzaak zijn van een aantal klachten die bij de overgang komen kijken.
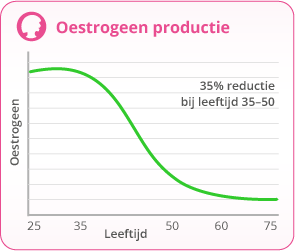
Wanneer je let op je gewicht en op je voeding, kun je ervoor zorgen dat er minder sprake is van oestrogeen-dominantie. De hormonale verandering gaat dan geleidelijk aan zonder hier veel van te merken. Je zorgt voor een goede balans in de hormonen en hebt weinig tot geen last van de klachten.
Goed voorbereid de overgang in!
Een gezond voedingspatroon en een gezond gewicht zijn dus belangrijk voor een gezonde hormoonhuishouding en zo min mogelijk overgangsklachten. Wanneer je gezond eet en leeft breng je je hormonen en zo ook oestrogeen en progesteron in balans.
Kom je er niet uit?
Met het persoonlijke voedingsplan van Nederland Slank kun je ervoor zorgen dat de overgang ongemerkt aan je voorbij gaat. Het wordt opgesteld aan de hand van bloedonderzoek en zorgt ervoor dat je hormoonbalans op orde komt. En dat je een gezond gewicht en lichaam krijgt.
Wil jij klachtenvrij de overgang door?
Vraag dan nu een consult aan en kom klachtenvrij de overgang door!
Vraag gratis video consult aan! (t.w.v. €195)
Meer info
- Het oestrogeenmetabolisme. Het hormonaal evenwicht herstellen. PlaceboNocebo 23.
- Verstoorde hormoonbalans bij vrouwen. Belangrijke oorzaak van borstkanker.
- PlaceboNocebo 39.
- Oestrogeen verlagende medicijnen. PlaceboNocebo 23.
Referenties:
Assad S, Khan HH, Ghazanfar H, et al. Role of Sex Hormone Levels and Psychological Stress in the Pathogenesis of Autoimmune Diseases. Cureus. 2017 Jun 5;9(6):e1315.
Bailey TG, Cable NT, Aziz N, et al. Exercise training reduces the frequency of menopausal hot flushes by improving thermoregulatory control. Menopause. 2016 Jul;23(7):708-18.
Baker FC, de Zambotti M, Colrain IM, et al. Sleep problems during the menopausal transition: prevalence, impact, and management challenges. Nat Sci Sleep. 2018 Feb 9;10:73-95.
Bani S, Hasanpour S, Farzad Rik L, et al. The effect of folic Acid on menopausal hot flashes: a randomized clinical trial. J Caring Sci. 2013 Jun 1;2(2):131-40.
Barakat R, Oakley O, Kim H, et al. Extra-gonadal sites of estrogen biosynthesis and function. BMB Rep. 2016 Sep;49(9):488-96.
Campbell L, Emmerson E, Davies F, et al. Estrogen promotes cutaneous wound healing via estrogen receptor beta independent of its antiinflammatory activities. J Exp Med. 2010 Aug 30;207(9):1825-33.
Carlson MJ, Thiel KW, Yang S, et al. Catch it before it kills: progesterone, obesity, and the prevention of endometrial cancer. Discov Med. 2012 Sep;14(76):215-22.
Catenaccio E, Mu W, Lipton ML, et al. Estrogen- and progesterone-mediated structural neuroplasticity in women: evidence from neuroimaging. Brain Struct Funct. 2016 Nov;221(8):3845-3867.
Charkoudian N. Skin blood flow in adult human thermoregulation: how it works, when it does not, and why. Mayo Clin Proc. 2003 May;78(5):603-12.
Chiechi LM, Putignano G, Guerra V, et al. The effect of a soy rich diet on the vaginal epithelium in postmenopause: a randomized double blind trial. Maturitas. 2003 Aug 20;45(4):241-6.
Choudhury F, Bernstein L, Hodis HN, et al. Physical activity and sex hormone levels in estradiol- and placebo-treated postmenopausal women. Menopause. 2011 Oct;18(10):1079-86.
Ciappolino V, Mazzocchi A, Enrico P, et al. N-3 Polyunsatured Fatty Acids in Menopausal Transition: A Systematic Review of Depressive and Cognitive Disorders with Accompanying Vasomotor Symptoms. Int J Mol Sci. 2018 Jun 23;19(7). pii: E1849.
Davey DA. Androgens in women before and after the menopause and post bilateral oophorectomy: clinical effects and indications for testosterone therapy. Womens Health (Lond). 2012 Jul;8(4):437-46.
Davinelli S, Scapagnini G, Marzatico F, et al. Influence of equol and resveratrol supplementation on health-related quality of life in menopausal women: A randomized, placebo-controlled study. Maturitas. 2017 Feb;96:77-83.
de Souza KZ, Vale FB, Geber S. Efficacy of Tribulus terrestris for the treatment of hypoactive sexual desire disorder in postmenopausal women: a randomized, double-blinded, placebo-controlled trial. Menopause. 2016 Nov;23(11):1252-1256.
Dean M, Murphy BT, Burdette JE. Phytosteroids beyond estrogens: Regulators of reproductive and endocrine function in natural products. Mol Cell Endocrinol. 2017 Feb 15;442:98-105.
Deroo BJ, Korach KS. Estrogen receptors and human disease. J Clin Invest. 2006 Mar;116(3):561-70.
Dizavandi FR, Ghazanfarpour M, Roozbeh N, et al. An overview of the phytoestrogen effect on vaginal health and dyspareunia in peri- and post-menopausal women. Post Reprod Health. 2019 Mar;25(1):11-20.
Dongre S, Langade D, Bhattacharyya S. Efficacy and Safety of Ashwagandha (Withania somnifera) Root Extract in Improving Sexual Function in Women: A Pilot Study. Biomed Res Int. 2015;2015:284154.
Dressing GE, Goldberg JE, Charles NJ, et al. Membrane progesterone receptor expression in mammalian tissues: a review of regulation and physiological implications. Steroids. 2011 Jan;76(1-2):11-7.
Eatemadnia A, Ansari S, Abedi P, et al. The effect of Hypericum perforatum on postmenopausal symptoms and depression: A randomized controlled trial. Complement Ther Med. 2019 Aug;45:109-113.
Fattah A. Effect of Phytoestrogen on Depression and Anxiety in Menopausal Women: A Systematic Review. J Menopausal Med. 2017 Dec;23(3):160-165.
Fernández-Alonso AM, Cuadros JL, Chedraui P, et al. Obesity is related to increased menopausal symptoms among Spanish women. Menopause Int. 2010 Sep;16(3):105-10.
Fogle RH, Stanczyk FZ, Zhang X, et al. Ovarian androgen production in postmenopausal women. J Clin Endocrinol Metab. 2007 Aug;92(8):3040-3.
Freedman RR. Pathophysiology and treatment of menopausal hot flashes. Semin Reprod Med. 2005 May;23(2):117-25.
Fuentes N, Silveyra P. Estrogen receptor signaling mechanisms. Adv Protein Chem Struct Biol. 2019;116:135-170.
Gong H, Jarzynka MJ, Cole TJ, et al. Glucocorticoids antagonize estrogens by glucocorticoid receptor-mediated activation of estrogen sulfotransferase. Cancer Res. 2008 Sep 15;68(18):7386-93.
Gordon JL, Rubinow DR, Eisenlohr-Moul TA, et al. Estradiol variability, stressful life events, and the emergence of depressive symptomatology during the menopausal transition. Menopause. 2016 Mar;23(3):257-66.
Hachul H, Brandão LC, D'Almeida V, et al. Isoflavones decrease insomnia in postmenopause. Menopause. 2011 Feb;18(2):178-84.
Hajirahimkhan A, Dietz BM, Bolton JL. Botanical modulation of menopausal symptoms: mechanisms of action? Planta Med. 2013 May;79(7):538-53.
Hammond GL. Plasma steroid-binding proteins: primary gatekeepers of steroid hormone action. J Endocrinol. 2016 Jul;230(1):R13-25.
Handa RJ, Ogawa S, Wang JM, et al. Roles for oestrogen receptor β in adult brain function. J Neuroendocrinol. 2012 Jan;24(1):160-73.
Hsieh CJ, Hsu YL, Huang YF, et al. Molecular Mechanisms of Anticancer Effects of Phytoestrogens in Breast Cancer. Curr Protein Pept Sci. 2018;19(3):323-332.
Hummelen R, Macklaim JM, Bisanz JE, et al. Vaginal microbiome and epithelial gene array in post-menopausal women with moderate to severe dryness. PLoS One. 2011;6(11):e26602.
Jackson SL, Scholes D, Boyko EJ, et al. Urinary incontinence and diabetes in postmenopausal women. Diabetes Care. 2005 Jul;28(7):1730-8.
Jarry H. Estrogen receptor beta and its selective ligands: an option for treatment of menopausal vasomotor symptoms? Horm Mol Biol Clin Investig. 2013 Dec;16(1):7-12.
Jordan VC. Selective estrogen receptor modulation: a personal perspective. Cancer Res. 2001 Aug 1;61(15):5683-7.
Kashani L, Esalatmanesh S, Eftekhari F, et al. Efficacy of Crocus sativus (saffron) in treatment of major depressive disorder associated with post-menopausal hot flashes: a double-blind, randomized, placebo-controlled trial. Arch Gynecol Obstet. 2018 Mar;297(3):717-724.
Khan SI, Zhao J, Khan IA, et al. Potential utility of natural products as regulators of breast cancer-associated aromatase promoters. Reprod Biol Endocrinol. 2011 Jun 21;9:91.
Kobayashi M, Sugiyama N, Sasayama D, et al. Sex differences in the serum level of endogenous ligands for estrogen receptor β in the elderly population. Sci Rep. 2016 May 11;6:25878.
Koo S, Ahn Y, Lim JY, et al. Obesity associates with vasomotor symptoms in postmenopause but with physical symptoms in perimenopause: a cross-sectional study. BMC Womens Health. 2017 Dec 8;17(1):126.
Larmo PS, Yang B, Hyssälä J, et al. Effects of sea buckthorn oil intake on vaginal atrophy in postmenopausal women: a randomized, double-blind, placebo-controlled study. Maturitas. 2014 Nov;79(3):316-21.
Lee A, Lee MR, Lee HH, et al. Vitamin D Proliferates Vaginal Epithelium through RhoA Expression in Postmenopausal Atrophic Vagina tissue. Mol Cells. 2017 Sep 30;40(9):677-684.
Lee JO, Kang SG, Kim SH, et al. The Relationship between Menopausal Symptoms and Heart Rate Variability in Middle Aged Women. Korean J Fam Med. 2011 Jul;32(5):299-305.
Lephart ED. Modulation of Aromatase by Phytoestrogens. Enzyme Res. 2015;2015:594656.
Lum SS, Woltering EA, Fletcher WS, et al. Changes in serum estrogen levels in women during tamoxifen therapy. Am J Surg. 1997 May;173(5):399-402.
Maruoka R, Tanabe A, Watanabe A, et al. Ovarian estradiol production and lipid metabolism in postmenopausal women. Menopause. 2014 Oct;21(10):1129-35.
McGregor C, Sau A, Ruddy SC, et al. Novel ligands balance estrogen receptor β and α agonism for safe and effective suppression of the vasomotor response in the ovariectomized female rat model of menopause. Endocrinology. 2014 Jul;155(7):2480-91.
Moon Z, Hunter MS, Moss-Morris R, et al. Factors related to the experience of menopausal symptoms in women prescribed tamoxifen. J Psychosom Obstet Gynaecol. 2017 Sep;38(3):226-235.
Muhleisen AL, Herbst-Kralovetz MM. Menopause and the vaginal microbiome. Maturitas. 2016 Sep;91:42-50.
Muka T, Vargas KG, Jaspers L, et al. Estrogen receptor β actions in the female cardiovascular system: A systematic review of animal and human studies. Maturitas. 2016 Apr;86:28-43.
Odai T, Terauchi M, Hirose A, et al. Severity of hot flushes is inversely associated with dietary intake of vitamin B6 and oily fish. Climacteric. 2019 Dec;22(6):617-621.
Parazzini F. Resveratrol, tryptophanum, glycine and vitamin E: a nutraceutical approach to sleep disturbance and irritability in peri- and post-menopause. Minerva Ginecol. 2015 Feb;67(1):1-5.
Park JY, Kim KH. A randomized, double-blind, placebo-controlled trial of Schisandra chinensis for menopausal symptoms. Climacteric. 2016 Dec;19(6):574-580.
Parnan Emamverdikhan A, Golmakani N, Tabassi SA, et al. A survey of the therapeutic effects of Vitamin E suppositories on vaginal atrophy in postmenopausal women. Iran J Nurs Midwifery Res. 2016 Sep-Oct;21(5):475-481.
Pestana-Oliveira N, Kalil B, Leite CM, et al. Effects of Estrogen Therapy on the Serotonergic System in an Animal Model of Perimenopause Induced by 4-Vinylcyclohexen Diepoxide (VCD). eNeuro. 2018 Jan 22;5(1). pii: ENEURO.0247-17.2017.
Ponnusamy S, Tran QT, Harvey I, et al. Pharmacologic activation of estrogen receptor β increases mitochondrial function, energy expenditure, and brown adipose tissue. FASEB J. 2017 Jan;31(1):266-281.
Postigo S, Lima SM, Yamada SS, et al. Assessment of the Effects of Tribulus Terrestris on Sexual Function of Menopausal Women. Rev Bras Ginecol Obstet. 2016 Mar;38(3):140-6.
Prange-Kiel J, Wehrenberg U, Jarry H, et al. Para/autocrine regulation of estrogen receptors in hippocampal neurons. Hippocampus. 2003;13(2):226-34.
Prior JC. Progesterone for Symptomatic Perimenopause Treatment - Progesterone politics, physiology and potential for perimenopause. Facts Views Vis Obgyn. 2011;3(2):109-20.
Rouen PA, Krein SL, Reame NE. Postmenopausal Symptoms in Female Veterans with Type 2 Diabetes: Glucose Control and Symptom Severity. J Womens Health (Larchmt). 2015 Jun;24(6):496-505.
Santoro N. Perimenopause: From Research to Practice. J Womens Health (Larchmt). 2016 Apr;25(4):332-9.
Scarpin KM, Graham JD, Mote PA, et al. Progesterone action in human tissues: regulation by progesterone receptor (PR) isoform expression, nuclear positioning and coregulator expression. Nucl Recept Signal. 2009 Dec 31;7:e009.
Schwenkhagen A. Hormonal changes in menopause and implications on sexual health. J Sex Med. 2007 Mar;4 Suppl 3:220-6.
Sternfeld B, Dugan S. Physical activity and health during the menopausal transition. Obstet Gynecol Clin North Am. 2011 Sep;38(3):537-66.
Swerdloff RS, Dudley RE, Page ST, et al. Dihydrotestosterone: Biochemistry, Physiology, and Clinical Implications of Elevated Blood Levels. Endocr Rev. 2017 Jun 1;38(3):220-254.
Taavoni S, Nazem Ekbatani N, et al. Valerian/lemon balm use for sleep disorders during menopause. Complement Ther Clin Pract. 2013 Nov;19(4):193-6.
Tagliaferri MA, Tagliaferri MC, Creasman JM, et al. A Selective Estrogen Receptor Beta Agonist for the Treatment of Hot Flushes: Phase 2 Clinical Trial. J Altern Complement Med. 2016 Sep;22(9):722-8.
Takacs P, Kozma B, Erdodi B, et al. Zinc-containing Vaginal Moisturizer Gel Improves Postmenopausal Vulvovaginal Symptoms: A Pilot Study. J Menopausal Med. 2019 Apr;25(1):63-68.
Thurston RC, Christie IC, Matthews KA. Hot flashes and cardiac vagal control during women's daily lives. Menopause. 2012 Apr;19(4):406-12.
Thurston RC, El Khoudary SR, Sutton-Tyrrell K, et al. Vasomotor symptoms and insulin resistance in the study of women's health across the nation. J Clin Endocrinol Metab. 2012 Oct;97(10):3487-94.
Vargas KG, Milic J, Zaciragic A, et al. The functions of estrogen receptor beta in the female brain: A systematic review. Maturitas. 2016 Nov;93:41-57.
Velders M, Schleipen B, Fritzemeier KH, et al. Selective estrogen receptor-β activation stimulates skeletal muscle growth and regeneration. FASEB J. 2012 May;26(5):1909-20.
Verhaeghe J. Menopause care for obese and diabetic women. Facts Views Vis Obgyn. 2009;1(2):142-52.
Weiser MJ, Foradori CD, Handa RJ. Estrogen receptor beta in the brain: from form to function. Brain Res Rev. 2008 Mar;57(2):309-20.
Xu Y, Sheng H, Bao Q, et al. NLRP3 inflammasome activation mediates estrogen deficiency-induced depression- and anxiety-like behavior and hippocampal inflammation in mice. Brain Behav Immun. 2016 Aug;56:175-86.
Yim G, Ahn Y, Chang Y, et al. Prevalence and severity of menopause symptoms and associated factors across menopause status in Korean women. Menopause. 2015 Oct;22(10):1108-16.
Zhao L, Huang S, Mei S, et al. Pharmacological activation of estrogen receptor beta augments innate immunity to suppress cancer metastasis. Proc Natl Acad Sci U S A. 2018 Apr 17;115(16):E3673-E3681.
Zhu BT, Han GZ, Shim JY, et al. Quantitative structure-activity relationship of various endogenous estrogen metabolites for human estrogen receptor alpha and beta subtypes: Insights into the structural determinants favoring a differential subtype binding. Endocrinology. 2006 Sep;147(9):4132-50.
Ziaei S, Kazemnejad A, Zareai M. The effect of vitamin E on hot flashes in menopausal women. Gynecol Obstet Invest. 2007;64(4):204-7.

