Is het een gelukkig gezin, financiële zekerheid of een uitstekende gezondheid? Of misschien is het wel alles samen? Geluk is voor iedereen anders, een moment van welbevinden dat vaak afhankelijk is van hoe je je voelt. Wanneer de hersenen echter niet genoeg gelukshormonen, zoals endorfine en oxytocine, aanmaken, kan het zijn dat je je minder gelukkig voelt. (Lees ook over Monique, de psycholoog)
Vaak liggen verkeerde eetgewoonten aan de basis van deze hormonale verstoringen. In plaats van de nieuwste medicijnen die honger dempen, geloven wij in een effectievere en duurzamere aanpak. Een programma op basis van bloedanalyse kan helpen de neurotransmitters weer in balans te brengen, wat niet alleen je gevoel van geluk kan verbeteren, maar je ook helpt om je gezondheidsdoelen te bereiken zonder afhankelijk te worden van tijdelijke oplossingen.
(red:
- Geen honger of verleidingen meer: Binnen een paar dagen merk je al dat je geen honger meer hebt. Snacks en verleidingen? Die laat je moeiteloos links liggen.
- Vetverlies dat motiveert: Het snelle en zichtbare resultaat motiveert je om door te gaan, terwijl je lichaam gezonder en sterker wordt.
- De Biologie van Geluk: Wij werken samen met jouw lichaam, niet ertegenin. Door de werking van neurotransmitters in balans te brengen, ga je je niet alleen beter voelen, maar wordt het ook makkelijker om keuzes te maken die bij jouw doelen passen.)
In een interview met Lucas Flamend praten we over hoe overeten en overgewicht het gevolg is van stress. En hoe een aangepaste voedingsstijl kan helpen om het tij te keren.......
*Aangepaste plaatsing van ons artikel op de website met misschien wel de grootste autoriteit in voedingsland.
Even technisch
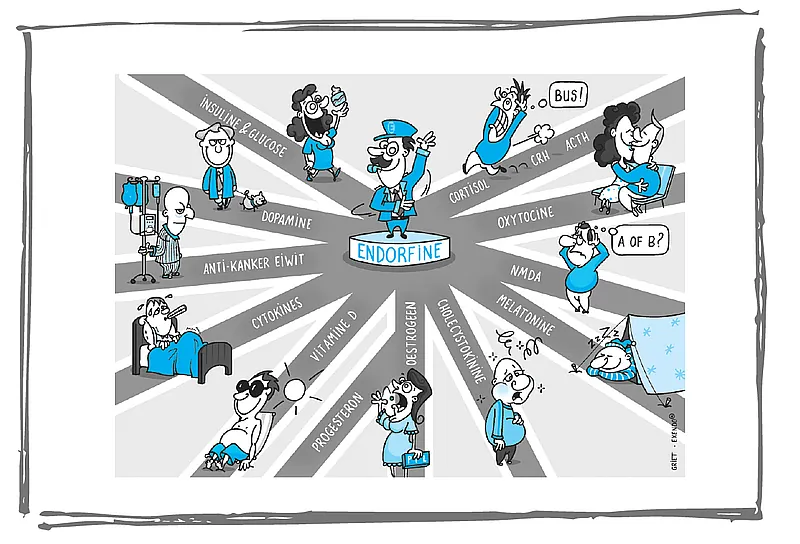
De twee belangrijkste geluksstofjes zijn neurotransmitters met een werkingsduur van slechts één tot vijftien minuten. Omdat het ene hormoon slechts zo kort aanhoudt heeft ze andere factoren nodig om de afgifte en de werking in stand te houden.
Daar komt de tweede neurotransmitter, endorfine om de hoek. Zij activeert de afgifte van gelukshormoon en zorgt ervoor dat ze langer haar werk kan blijven doen. De totale kwaliteit van dit beloningssysteem is echter van nog meer factoren afhankelijk: de hoeveelheid geluksstoffen in het lichaam en de gevoeligheid van de receptoren die de geluksstoffen in het lichaam actief houden en transporteren.
Als die receptoren minder aanwezig, of gevoelig zijn, kan dit leiden tot endorfine- of gelukshormoon-resistentie waardoor men meer en meer op zoek gaat naar bevrediging. Dit kan leiden tot verslavingen als bijvoorbeeld een eetstoornis.
Van redelijk tevreden tot chemisch euforisch
Je kunt geluk zelfs in schalen van intensiteit indelen. Ben je gewoon tevreden, of ben je euforisch gelukkig? Over het algemeen, als het hele beloningssysteem doet wat het moet, voelen we ons gewoon lekker tevreden.
In elk mensenleven vinden 'gelukkig' ook euforische momenten plaats; de eerste keer dat je fantastische seks hebt, de geboorte van je kind, je huwelijk, dat droomhuis dat je eindelijk samen kan kopen. Het gevaar van euforie is echter dat je snel verlangt naar herhaling. Helaas is een tweede, gelijkwaardige herhaling van die allereerste extatische beleving bijna niet te evenaren.
Vooral mensen die een mager endorfine-voorraadpotje hebben kan dit leiden tot een behoefte aan vervanging van dit geluksgevoel door onnatuurlijke middelen als XTC, cocaine, amfetamine, alcohol of zogenaamde 'troostvoeding'. Echter ook hiervoor geldt: des te meer herhaling, des te ongevoeliger het beloningssysteem hiervoor wordt.

De voedselhunkering
Je bent doodmoe, je bent tot de max gestresst, je bent (liefdes)verdrietig...waar verlang je naar? Juist: troostvoeding. Helaas bestaat dit soort eten uit zaken die weliswaar onze gelukshormonen en neurotransmitter-levels tijdelijk verhogen, maar echt niet goed voor ons zijn. Denk daarbij aan suikers en snelle koolhydraten gecombineerd met foute vetten en exorfinen (morfine-achtige stoffen gluten, tarwe roggen en gerst).
Deze zijn te vinden in je geliefde frisdranken, koekjes, gebakjes, snoep, friet, roomijs, aardappelpuree en chocolade. Junkfood gaat nóg een stapje verder. Dit is vergelijkbaar met bovenstaand lijstje maar dan met een nog lageren nutritionele waarde; veel verzadigde vetten, veel zout en smaakversterkers.
Hier vallen de Febokroket, De Mac-hamburger en die maxizak chips onder. Omdat de piek in endorfinen etc net zo snel weer afneemt als hij opkwam door deze voedingsmiddelen, is ons verlangen naar meer en meer bijna niet te stoppen. Vooral als dit (eet)gedrag in de pre-pubertijd is aangeleerd zijn de hersenen gewend geraakt zich aan deze snelle toe- en afname aan te passen.

Het is de schuld van je ouders
Als je ouders hebt die lijden aan overgewicht, stress of depressie heb je als kind helaas een hogere kans op een zwakker beloningssysteem. Ook als je moeder tijdens de zwangerschap veel troostvoeding, geneesmiddelen of alcohol consumeerde heeft dit invloed op jou als ongeboren kind. Ben je op de wereld gezet met behulp van het opiaat oxytocine om de bevalling in te leiden of heb je het als kind ook nog zonder de (brood)nodige aandacht en liefde moeten stellen, dan zal je beloningssysteem extreem uit balans zijn.
Wat is de oplossing? Vraag een gratis consult aan!
- zie het originele artikel op Natuurdietisten

Het uitgeputte beloningssysteem
De uitputting van het beloningssysteem kan in fasen ingedeeld worden:
Upregulatie: je hersenen krijgen in korte tijd een stoot endorfine en gelukshormonen te verwerken. Deze piek daalt echter ook weer supersnel zodat je een paar uur nadat je die zak chips hebt verorberd alweer kunt hunkeren naar een bak ijs.
Downregulatie: hierbij doen de hersenen het omgekeerde als bij de upregulatiefase. Ze zorgen ervoor dat er minder beloningsstoffen geactiveerd kunnen worden. Kinderen die erfelijk belast zijn zullen hierdoor al snel symptomen van een verzwakt beloningssysteem gaan vertonen. Dit vertaalt zich vertaalt in AD(H)D, dysforie (verminderde plezierbeleving), concentratieproblemen en uitstelgedrag. Al met al ervaart men in deze fase minder beloning waardoor de consumptie van troostvoeding toeneemt, met als gevolg stemmingswisselingen, irritatie, onrust en stress.
Aversiefase: hierbij is niet alleen het beloningssysteem verstoord maar ook het antibeloningssysteem. Dit is het systeem dat zorgt dat stress, onrust, agitatie en mentale of lichamelijke vermoeidheid gereguleerd worden. Je merkt dit aan het feit dat je leuke dingen gaat vermijden of die negatieve gedachteknop niet meer uit kunnen zetten. Bij zowel vrouwen als mannen kan dit leiden tot verlaagd libido en bij de laatsten tot erectiestoornissen. De meest extreme vormen van deze fase uit zich in de zogenaamde uitputtingsaandoeningen zoals burn-out, PTSS en depressie.

Je dealer, aka; de voedingsindustrie
De voedingsindustrie maakt maar wat gretig gebruik van het feit dat troost- en junkvoeding een verleider is waar maar weinig mensen weerstand aan kunnen bieden. Zij bewerken ons eten met opzet dermate dat het maximale genotspunt wordt bereikt. Een combinatie van scheikundige en marketingelementen moet garant staan voor dit verwoestende effect. Zo kunnen de producten samengesteld worden om maximaal genot te verschaffen en tegelijkertijd vermarkt worden als 'gezond'. Echter de toename aan obesitas, diabetes type 2, depressie en ADHD laat een andere kant van dit verhaal zien.
Zoals we hierboven gelezen hebben verzwakt langdurig 'gebruik' van dergelijk samengestelde voedingsmiddelen de natuurlijke werking van het genots-systeem en verhoogt stress- en prikkelgevoeligheid. De medicijnenindustrie verhult deze symptomen alleen maar zonder ze bij de bron, de voeding, aan te pakken. Denk hierbij aan methylfenidaat, dexamfetamine of de benzodiazepines waaronder vele slaap en kalmeringsmiddelen onder vallen.

Je slachtofferstemmetje versus liefde en aandacht
Een totaal herstel van het beloningssysteem kan alleen plaats vinden door een totale reset. Dit gebeurt door de factoren die overstimulatie veroorzaken te verminderen. Verandering van het voedingspatroon is daarvan een belangrijk onderdeel.
Uiteraard zullen de hersenen in de eerste instantie protesteren. Je zult het bekende ‘slachtofferstemmetje’ horen. Zij beschikt over een rijk repertoire aan argumenten: 'waarom zou suiker en brood ongezond zijn als iedereen het eet? En als E621 zo schadelijk was, waarom laat de gezondheidsinspectie dit dan toe?' Of: 'wat voel ik me zielig als ik uitgenodigd ben en iedereen aan de taart gaat.'
Wie echter aandachtig luistert naar die innerlijke saboteur, merkt dat zij gewoon bang is om een oude gewoonte te doorbreken. Net zoals we bang zijn een slechte relatie te beëindigen omdat we dan de gehechtheid en het vertrouwde verlaten.
Uit onderzoek blijkt echter dat onze hersenen na gemiddeld een half jaar zijn afgekickt van troostvoeding en junkfood. Onze genen zijn helemaal niet gemaakt voor een onafgebroken bombardement aan genotsstoffen. Ze zijn gebaat bij een omgeving die voedend in plaats van uitputtend werkt. Dat wil zeggen meer bewegen, het opzoeken van de natuur, de stilte (bv. meditatie) en het voeden van de hartenergie: liefde én aandacht!
Wat is de oplossing? Vraag een gratis consult aan!

1. Victor Brantl et al. Opioid activities of β-casomorphins. Opioid activities of β-casomorphins. Life Sciences, Volume 28, Issue 17, 27 April 1981, Pages 1903–1909
2. H. Teschemacher. Opioid Receptor Ligands Derived from Food Proteins. Current Pharmaceutical Design, 2003, 9, 1331-1344
3. Kaneko K. et al. Orally administered soymorphins, soy-derived opioid peptides suppress feeding and intestinal transit via gut receptor coupled to 5-HT1A, D2 and GABAB systems. Am J Physiol Gastrointest Liver Physiol. 2010 Jul 8.
4. Giuseppe Fanciullia et al. Gluten exorphin B5 stimulates prolactin secretion through opioid receptors located outside the blood-brain barrier. Life Sciences 76 (2005) 1713–1719.
5. Herrera-Marschitz M. et al. Rotational behaviour produced by intranigral injections of bovine and human beta-casomorphins in rats. Psychopharmacology (Berl). 1989;99(3):357-61.
6. Lawrence H. et al. DimericDermorphin Analogues as p-Receptor Probes on Rat Brain membranes. THE JOURNAL OF BIOLOGICAL CHEMISTRY Vol. 264, No. 1, Issue of January 5, pp. 354-362,1989 7. Keith Woodford. Milk Proteins and Human Health:A1 versus A2 Beta-casein. Agriculture and Life Sciences Division, Lincoln University, NZ. An invited plenary paper to the International Diabetes Federation Western PacificCongress, Wellington, 2 April 2008.
8. Bartley J et al. Does milk increase mucus production? Med Hypotheses. 2010 Apr;74(4):732-4. Epub 2009 Nov 25.
9. Philippa Ellwood et al. Do fast foods cause asthma, rhinoconjunctivitis and eczema? Global findings from the International Study of Asthma and Allergies in Childhood (ISAAC) Phase Three. Thorax doi:10.1136/thoraxjnl-2012-202285.
10. Serum activity of dipeptidyl peptidase IV (DPPIV; EC 3.4.14.5) in breast-fed infants with symptoms of allergy.
11. Sun Z. Relation of beta-casomorphin to apnea in sudden infant death syndrome. Peptides. 2003 Jun;24(6):937-43.
12. Cao Y. et al. Isoflavones in urine, saliva, and blood of infants: data from a pilot study on the estrogenic activity of soy formula.J Expo Sci Environ Epidemiol. 2009 Feb;19(2):223-34. doi: 10.1038/jes.2008.44. Epub 2008 Jul 30.
13. Ohinata K. et al. Soymorphins, novel mu opioid peptides derived from soy beta-conglycinin beta-subunit, have anxiolytic activities. nBiosciBiotechnolBiochem. 2007 Oct;71(10):2618-21. Epub 2007 Oct 7.
14. Gonzales KL. Et al. The influences of reproductive status and acute stress on the levels of phosphorylated mu opioid receptor immunoreactivity in rat hippocampus. Front Endocrinol (Lausanne). 2011 Aug 19;2(18). pii: 00018.
15. Bortsov AV. Et al. Mu-Opioid receptor gene A118G polymorphism predicts survival in patients with breast cancer. Anesthesiology. 2012 Apr;116(4):896-902. doi: 10.1097/ALN.0b013e31824b96a1.
16. Ohinata K. et al. Evidence for opioid receptors on cells involved in host defense and theimmune system.BiosciBiotechnolBiochem. 2007 Oct;71(10):2618-21. Epub 2007 Oct 7.
17. Hartrodt B. et al. Synthesis and enzymatic degradation of beta-casomorphin-5. Pharmazie. 1982 Mar;37(3):165-9.
18. Gerhard Püschel et al. Isolation and characterization of Dipeptidyl Peptidase IV from human placenta. European Journal of Biochemistry. – ISSN 0014-2956. – 126 (1982), 2, p. 359-365DOI 10.1111/j.1432-1033.1982.tb06788.x.
19. Pascual I. et al. Effect of divalent cations on the porcine kidney cortex membrane-bound form of dipeptidyl peptidase IV.Int J Biochem Cell Biol. 2011 Mar;43(3):363-71. doi: 10.1016/j.biocel.2010.11.006. Epub 2010 Nov 17.
20. García-Piñeres AJ. Et al. Gene expression patterns induced by HPV-16 L1 virus-like particles in leukocytes from vaccine recipients.J Immunol. 2009 Feb 1;182(3):1706-29.
21. Sorrell JM. Et al. Cytokines and glucocorticoids differentially regulate APN/CD13 and DPPIV/CD26 enzyme activities in cultured human dermal fibroblasts.Arch Dermatol Res. 2003 Aug;295(4):160-8. Epub 2003 Jul 12.
22. (histamine is een Dynorphin/KOR activator dat een DPP-IV remmende werking heeft) Burban A. et al. Histamine potentiates N-methyl-D-aspartate receptors by interacting with an allosteric site distinct from the polyamine binding site.J PharmacolExpTher. 2010 Mar;332(3):912-21. doi:
10.1124/jpet.109.158543. Epub 2009 Dec 15. 23. Stefanović V. et al. Kidney ectopeptidases in gentamicin and mercuric chloride-induced acute renal failure.Cell PhysiolBiochem. 1998;8(5):278-84.
24. Taldone T. et al. Inhibition of dipeptidyl peptidase-IV (DPP-IV) by atorvastatin.Bioorg Med ChemLett. 2008 Jan 15;18(2):479-84. Epub 2007 Dec 3.
25. Al-masri IM. Et al. Inhibition of dipeptidyl peptidase IV (DPP IV) is one of the mechanisms explaining the hypoglycemic effect of berberine.J Enzyme Inhib Med Chem. 2009 Oct;24(5):1061-6. doi: 10.1080/14756360802610761.
26. Gabrilovac J. et al. Dipeptidyl peptidase IV (DPPIV) enzyme activity on immature T-cell line R1.1 is down-regulated by dynorphin-A(1-17) as a non-substrate inhibitor.Life Sci. 2003 May 30;73(2):151-66.
27. Wiley MD. Et al. Kappa-opioid system regulates the long-lasting behavioral adaptations induced by early-life exposure to methylphenidate.Neuropsychopharmacology. 2009 Apr;34(5):1339-50. doi: 10.1038/npp.2008.188. Epub 2008 Oct 15.
28. Vu C. Dang and John T. Williams. Chronic Morphine Treatment Reduces Recovery fromOpioid Desensitization. The Journal of Neuroscience, September 1, 2004• 24(35):7699–7706 • 7699
29. Hernandez MC. Et al. Immunosuppression by morphine is mediated by central pathways.J PharmacolExpTher. 1993 Dec;267(3):1336-41.
30. Kalpna Gupta. Et al. Morphine Stimulates Angiogenesis by Activating Proangiogenic and Survival-promoting Signaling and Promotes Breast Tumor Growth 1. Cancer Res August 1, 2002 62; 4491.
31. Pedro Rada et al. Opioids in the hypothalamus control dopamine and acetylcholinelevels in the nucleus accumbens. Brain Res. 2010 February 2; 1312: 1–9. doi:10.1016/j.brainres.2009.11.055.
32. Chang KJ. Et al. Isolation of a specific mu-opiate receptor peptide, morphiceptin, from an enzymatic digest of milk proteins. J Biol Chem. 1985 Aug 15;260(17):9706-12.
33. Suzuki T; Misawa M. Opioid receptor types and dependence. Nippon YakurigakuZasshi, 1997 Apr, 109:4, 165-74
34. Butelman ER. Et al. Kappa-Opioid receptor agonist-induced prolactin release inprimates is blocked by dopamine D(2)-like receptor agonists.Eur J Pharmacol. 2001 Jul 6;423(2-3):243-9.
35. K. J. Jackson. Et al. Effect of the selective kappa-opioid receptor antagonist JDTic onnicotine antinociception, reward, and withdrawal in the mouse. Psychopharmacology (Berl). 2010 June; 210(2): 285–294. doi:10.1007/s00213-010-1803-1.
36. (NMDA wordt aangestuurd door de KOR receptor) Lehohla M. et al. NMDA receptor function in the prefrontal cortex of a rat modelfor attention-deficit hyperactivity disorder.Metab Brain Dis. 2004 Jun;19(1-2):35-42.
37. Gabrilovac J. et al. Dipeptidyl peptidase IV (DPPIV) enzyme activity on immature T-cell line R1.1 is down-regulated by dynorphin-A(1-17) as a non-substrate inhibitor.Life Sci. 2003 May 30;73(2):151-66.
38. Volterra A. et al. Interaction of beta-casomorphins with multiple opioid receptors: in vitro and in vivo studies in the newborn ratbrain. Brain Res. 1986 Nov;395(1):25-30.
39. Cheol Kyu Hwang. Et al. Evidence of Endogenous Mu Opioid Receptor Regulation byEpigenetic Control of the Promoters. MOLECULAR AND CELLULAR BIOLOGY, July 2007, p. 4720–4736.
40. Laura M. Bohn. Et al. G Protein-Coupled Receptor Kinase/β-ArrestinSystems and Drugs of Abuse. NeuroMolecular Medicine, 2004.
41. Sokolov OY,. Et al. Reactions between beta-casomorphins-7 and 5-HT2-serotonin receptors. Bull ExpBiol Med. 2005 Nov;140(5):582-4.
42. Mary C. Olmstead et al. Mu and Delta Opioid Receptors Oppositely Regulate Motor Impulsivity in the Signaled Nose Poke Task. PLoS ONE. 2009; 4(2): e4410.
43. Hansjorg Teschemacher. Et al. Milk Protein-Derived Opioid Receptor Ligands. Institut fu ¨ r Pharmakologie und Toxikologie, 1997.
44. Kaneko K. et al. Orally administered soymorphins, soy-derived opioid peptides suppress feeding and intestinal transit via gut receptor coupled to 5-HT1A, D2 and GABAB systems. Am J PhysiolGastrointest Liver Physiol. 2010 Jul 8.
45. Fukudome S. et al. Opioid peptides derived from wheat gluten: their isolation and characterization.FEBS Lett. 1992 Jan 13;296(1):107-11.
46. Hirata H. et al. Rubiscolin-6, a delta opioid peptide derived from spinach Rubisco, has anxiolytic effect via activating sigma1 anddopamine D1 receptors.Peptides. 2007 Oct;28(10):1998-2003. Epub 2007 Jul 27.
47. George R. Kracke. Et al. Sugar Solution Analgesia: The Effects of Glucose on Expressed Mu Opioid Receptors. AnesthAnalg 2005;101:64–8
48. SumitaChakrabarti et al. Formation of μ-/κ-opioid receptor heterodimer issex-dependent and mediates female-specific opioid analgesia. ProcNatlAcadSci U S A. 2010 Nov 16;107(46):20115-9. doi: 10.1073/pnas.1009923107. Epub 2010 Nov 1.
49. Rhian M. Evans. Et al. Heterodimerization of ORL1 and Opioid Receptors and Its Consequences for N-typeCalcium Channel Regulation. J Biol Chem. 2010 January 8; 285(2): 1032–1040.
50. Andras Bilkei-Gorzo. Et al. Dynorphins Regulate Fear Memory: from Mice to Men. The Journal of Neuroscience, 4 July 2012, 32(27): 9335-9343; doi: 10.1523/JNEUROSCI.1034-12.2012.
51. Bartley J et al. Does milk increase mucus production? Med Hypotheses. 2010 Apr;74(4):732-4. Epub 2009 Nov 25.
52. Jarmołowska B. et al. Serum activity of dipeptidyl peptidase IV (DPPIV; EC 3.4.14.5) in breast-fed infants with symptoms of allergy.Peptides. 2007 Mar;28(3):678-82. Epub 2007 Jan 3.
53. Jarmołowska B. et al. Do fast foods cause asthma, rhinoconjunctivitis andeczema? Global findings from the International Study of Asthma and Allergies in Childhood (ISAAC) Phase Three. Thorax doi:10.1136/thoraxjnl-2012-202285.
54. Baldock, PA. et al. Endorphins regulate bone homeostasis by actions through dynorphin. Volume 42, Supplement 1 , Pages S43-S44, March 2008.
55. Baldock PA. et al. The endogenous opioid dynorphin is required for normal bone homeostasis in mice.Neuropeptides. 2012 Dec;46(6):383-94. doi: 10.1016/j.npep.2012.08.010. Epub 2012 Oct 9.
56. Heike A Bischoff-Ferrari. Et al. Calcium intake and hip fracture risk in men and women: a metaanalysisof prospective cohort studies and randomized controlled trials. Am J ClinNutr 2007;86:1780–90.
57. Ribeiro SC. Et al. Interface of physical and emotional stressregulation through the endogenous opioid system and mu-opioid receptors.ProgNeuropsychopharmacolBiol Psychiatry. 2005 Dec;29(8):1264-80. Epub 2005 Oct 26.
58. Hoffman L. et al. Low plasma beta-endorphin in post-traumatic stress disorder.Aust N Z J Psychiatry. 1989 Jun;23(2):269-73.
59. Ward GR. Et al. Glucocorticoids plus opioids up-regulate genes that influence neuronalfunction.Cell Mol Neurobiol. 2007 Aug;27(5):651-60.
60. Billert H. et al. Influence of beta-endorphin on the production of reactive oxygen and nitrogenintermediates by rabbit alveolar macrophages.Gen Pharmacol. 1998 Sep;31(3):393-7.
61. Mørch H. et al. Beta-endorphin and the immune system–possible role in autoimmune diseases.Autoimmunity. 1995;21(3):161-71.
62. Jinghua Wang. Et al. Mu-Opioid Receptor Mediates Chronic Restraint Stress-Induced Lymphocyte Apoptosis. J Immunol. 2002 Oct 1;169(7):3630-6.
63. Guang-Ping Xu. Et al. Chronic Morphine Sensitizes the Brain NorepinephrineSystem to Corticotropin-Releasing Factor and Stress. The Journal of Neuroscience, September 22, 2004• 24(38):8193–8197 • 8193.
64. Rachel Y Chong. Et al. The Mu-Opioid Receptor Polymorphism A118G PredictsCortisol Responses to Naloxone and Stress. Neuropsychopharmacology (2006) 31, 204–211.
65. ChristophSchwarzer30 Years of Dynorphins – New Insights on Their Functions in Neuropsychiatric Diseases. PharmacolTher. 2009 September; 123(3): 353–370.
66. Traci A. Czyzyk. Et al. κ-Opioid receptors control the metabolic response to a high-energy diet in mice. FASEB J. 2010 April; 24(4): 1151–1159.
67. Kurek M. et al. A naturally occurring opioid peptide from cow’s milk, beta-casomorphine-7, is a directhistamine releaser in man.1: Int Arch Allergy Immunol. 1992;97(2):115-20.
68. Food Peptides – A New Class of Hormones?JAMA, May 7, 1982—Vol 247, No. 17.
69. Mitsuma T. et al. Beta-casomorphin inhibits thyrotropin secretion in rats.ExpClinEndocrinol. 1984 Dec;84(3):324-30.
70. Z. Y. Ong and B. S. Muhlhausler. Maternal “junk-food” feeding of rat dams alters foodchoices and development of the mesolimbic reward pathway in the offspring. FASEB Journal article fj.10-178392. Published online March 22, 2011.
71. BadreddineBencherif. Et al. Regional .-Opioid Receptor Binding in Insular Cortex Is Decreased in Bulimia Nervosa and Correlates Inversely with Fasting Behavior. J Nucl Med. 2005 Aug;46(8):1349-51.
72. Contet C. et al. Mu opioid receptor – a gateway to drug addiction.Curr Opin Neurobiol. 2004 Jun;14(3):370-8.
73. Julie Le Merrer et al. Reward Processing by the Opioid System in the Brain. Physiol Rev 89: 1379–1412, 2009;doi:10.1152/physrev.00005.2009.
74. Carlo Colantuoni. Et al. Evidence That Intermittent, Excessive Sugar Intake Causes Endogenous Opioid Dependence. Obesity Research Vol. 10 No. 6 June 2002.
75. Kyle S Burger and Eric Stice.Frequent ice cream consumption is associated with reduced striatal response to receipt of an ice cream–based milkshake. Am J ClinNutr April 2012 ajcn.027003.
